عوامل اتیولوژیك بیماری از تمام گروهها (باكتریها، قارچها، ویروسها و انگلها) ممكن است در داخل بافتهای بدن یا مایعات بدن یافت شوند. در این فصل در بارة انواع میكروارگانیسم هائی كه احتمالاً از نمونه های بافتی، استخوان – مغز استخوان و مایعات استریل بدن جدا می گردند بحث می شود. باكتریها، قارچها و ویروسها را می توان بوسیلة روشهای میكروبشناسی در آزمایشگاه تشخیص داد و بحثی كه بعداً خواهد آمد بر روی این عوامل متمركز می شود. بدلیل اینكه وجود حتی یك كلنی از یك باكتری پاتوژن می تواند با اهمیت باشد و به دلیل اینكه این نمونه ها نسبت به سایر نمونه ها بیشتر به آزمایشگاه فرستاده می شود، توصیه می گردد كه تمام مراحل كار بر روی نمونه، انتقال نمونه و كشت بر روی محیط بوسیلة یك تكنولوژیست ماهر كه دارای دستكش بوده و در زیر هودهای ایمنی بیولوژیك كار می كند، انجام شود.
در اغلب موارد تشخیص و شناسائی انگلها در بافت با استفاده از خصوصیات ساختمانی و مورفولوژیك آنها در برش رنگ آمیزی شده بافت شناسی صورت می گیرد. آزمایش و تشخیص انگلها در بافت بوسیلة پاتولوژیست انجام می شود. اما در اغلب موارد عفونت با پنوموسیستیس كارینی تشخیص بوسیلة میكروبیولوژیست از مواد بیوپسی شده ریه صورت می گیرد. گاهی در نمونه مرطوب تهیه شده از مایع پلور ممكن است آنتاموباهیستولیتیكا وجود داشته باشد. این انگل را می توان در نمونه های گرفته شده از دیواره یك آبسه آمیبی كبدی شناسائی نمود. سایر بافتها را می توان جهت انگلهائی مانند لیشمانیا و تریپانوزوما كشت داد.
1- مایعات استریل بدن
در پاسخ به یك عفونت، در هر حفره بدن ممكن است مایع تجمع پیدا كند. بافت های سخت اغلب ایجاد فلگمون، سلولیت یا آبسه می نمایند. مناطقی از بدن كه معمولا مایعات آنجا را جهت مطالعات میكروبشناسی ارسال می كنند (علاوه بر خون و مایع مغزی نخاعی ) عبارتند از:
- قفسه سینه (مایع پلور)، حفره شكمی (مایع آسیت یا مایع پاراسنتز یا مایع پریتون). مفاصل (مایع مفصلی)، پریكارد (مایع پریكارد).
تكنیك های آزمایشگاهی جهت كار بر روی تمام مایعات استریل بدن بیشتر اوقات مشابه است. مایع شفاف را می توان بوسیلة سانتریفوژ كردن یا فیلتراسیون تغلیظ نمود. در صورتیكه مواد چركی را می توان مستقیماً به محیط كشت تلقیح نمود. هر مایع بدنی كه به صورت لخته به آزمایشگاه رسید بایستی جهت آزاد شدن باكتریهای مخفی در لخته هموژنیزه شده و جهت آزاد شدن سلولهای قارچی باید خرد شود. آماده سازی چنین نمونه هائی بایستی در دستگاه گریندر بافتی یا با استفاده از یك هاون و دسته هاون یا گریندر بافتی شیشه ای انجام شود تا باكتریها بهتر جدا شوند. خرد كردن ممكن است عناصر قارچی را از بین ببرد، بنابراین جهت نمونه ای قارچی توصیه نمی شود. جهت جداسازی قارچها بایستی قطعه ای از نمونه را با اسكالپل بریده و مستقیماً بر روی محیط كشت قرار داد.
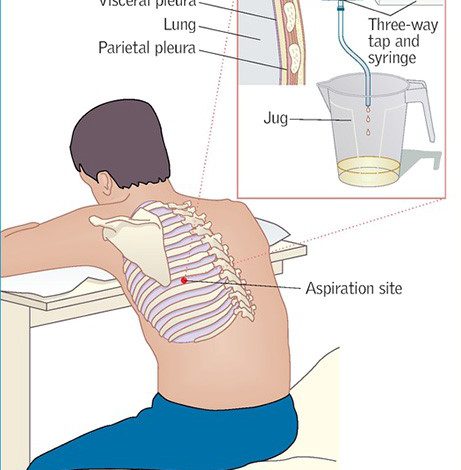
الف- مایع پلور (جنب) (Pleural fluid)
مایع پلور یا افیوژن پلور، جمع شدن مایع در فضای پلور (جنب) می باشد. فاصلة بین ریه و دیواره قفسه سینه را فضای جنبی می گویند. مایع ممكن است دارا یا فاقد سلول و تركیبات آن شبیه سرم باشد (با پروتئین كمتر). این نوع مایع را ترانسودا (Transudate) می گویند كه اغلب تشكیل آن در نتیجة بیماریهای قلبی، كبدی و كلیوی است مایع پلوری كه دارای تعداد زیادی گلبول سفید و شواهد دیگری از یك پاسخ التهابی باشد معمولاً ناشی از عفونت است، اما بدخیمی ها، آنفاركتوس ریه، یا بیماریهای خود ایمنی كه در آن واكنش بین آنتی ژن – آنتی بادی آغازگر یك پاسخ التهابی است نیز ممكن است مسئول باشند. چنین مایعی اگزودا (Exudate) نامیده می شود و معمولاً این مایع به آزمایشگاه میكروبشناسی ارسال می گردد. این نمونه معمولا بوسیلة آسپیراسیون سوزنی (Thoracentesis) جمع آوری می شود و با نام مایع پلور، مایع توراسنتز یا مایع امپیما (Emphyma fluid) به آزمایشگاه فرستاده می شود. مایع پلور اگزوداتیوی كه دارای تعداد زیادی نوتروفیل بوده و به طور مشخص چركی باشد مایع امپیما نامیده می شود. اپیما متعاقب پنومونی ایجاد می شود، اما سایر عفونت هایی كه نزدیك به ریه ایجاد می شوند (مثلاً عفونت زیر دیافراگم) ممكن است موجب كاستن میكروارگانیسم ها در فضای پلور گردند. باكتریهائی كه از مایع پلور جدا می شوند همان باكتریهائی هستند كه ایجاد پنومونی می كنند مانند استرپتوكوكوس پنومونیه، استافیلوكوك اورئوس، هموفیلوس آنفلوآنزا، انتروباكتریاسه، سودوموناس و باكتریهای بیهوازی. ارگانیسم های بیهوازی در مایع پلور یا امپیما، ثانویه به پنومونی آسپیراسیون یا عوارض آن (آبسه ریوی) هستند و با شیوع كمتر سایر استرپتوكوكها، مایكوباكتریوم توبركلوزیس و مایكوباكتریهای غیرتوبركلوزی، گونه های اكتینومایسس، گونه های نوكاردیا، قارچها و ندرتاً مایكوپلاسما، ویروسها ممكن است از كشت امپیما ایزوله گردند. مایع پلور همانند سایر مایعات استریل بدن باید در یك لوله استریل ویالی كه اكسیژن آن خارج شده و یا به آزمایشگاه منتقل شود. 5-1 میلی لیتر نمونه جهت جداسازی بیشتر باكتریها كافی است، اما مقادیر بیشتر خصوصاً در مورد جداسازی مایكوباكتریوم و قارچها بهتر است، ویالهای انتقال بیهوازی به طور تجاری موجودند. این ویالها در شرایط بدون اكسیژن تهیه شده و درب آنها با چوب پنبه، پلاستیك یا یك درپیچ كوتاه بسته شده و از طریق آنها مایع را به داخل ویال می توان تزریق نمود. مایع پلور را می توان بوسیلة سرنگی كه سر آن بسته شده سریعاً به آزمایشگاه انتقال داد. اما این روش نسبت به ویالهای آماده مزیت كمتری دارد. بیشتر باكتریهای مهم از نظر بالینی به طور مناسب در ظروف انتقال بیهوازی (مانند سرنگ و لوله های درپیچدار استریل)، اگر چركی باشند و مقدار آنها كافی باشد، بمدت كوتاهی زنده می مانند. نمونه هائی كه در سرنگ یا لوله های انتقال بیهوازی به آزمایشگاه می رسند باید حتی الامكان هر چه سریعتر در محیط های معمول هوازی و بیهوازی كشت داده شوند و رنگ آمیزی گرم روی آنها انجام گردد. اگر باسیل های گرم – مثبت با رشته های طویل و نازك دیده شوند، باید گسترش دیگری را جهت رنگ آمیزی اسید – فاست تغییر یافته جهت نوكاردیا آماده نمائیم. باسیلهای رشته ای كه اسید – فاست نباشند معمولا گونه های اكتینومایسس هستند.
نمونه جهت جداسازی مایكوباكتریها و قارچها باید در لوله های درپیچ دار استریل منتقل شوند. حداقل 10 تا 15 میلی لیتر از مایع مورد نظر جهت جداسازی مناسب ارگانیسم هائی كه به تعداد كم در مایع وجود دارند لازم است. نمونه هائی كه مقداری رقیق هستند بوسیلة سانتریفوژ كردن نمونه در g×1500 به مدت حداقل 15 دقیقه تغلیظ می شوند. مایع روئی باید به روش آسپتیك و با استفاده از یك پیپت استریل خارج شده و یك میلی لیتر از مایع روئی جهت مخلوط كردن نمونه باقی بماند. با استفاده از یك پیپت استریل نمونه را چند مرتبه بالا و پائین می كشیم تا رسوب بخوبی به صورت سوسپانسیون درآید. البته باید این كارها را در زیر هودبیولوژیك انجام داد. از سوسپانسیون آماده می توان جهت كشت و تهیه گسترش استفاده نمود. نمونه مایع را جهت بررسی قارچها علاوه بر رنگ آمیزی گرم باید به روش مرطوب نیز مورد آزمایش قرار داد. از هیدروكسیدپتاسیم 10% یا رنگ كالكوفلور سفید می توان جهت مشاهده عناصر قارچی استفاده نمود. علاوه بر اشكال میسیلیومی، مواد حفرة توراسیك ممكن است حاوی اسفرولهای كوكسیدیوئیدس یا سلولهای مخمری جوانهدار باشند. محیط های كشتی كه از رشد قارچها حمایت می كنند شامل BHI آگار (كه با خون گوسفند و آگار ممانعت كننده از رشد كپك تكمیل شده است) می باشد. از آنجائیكه گونه های لژیونلا اغلب از مایع پلور جدا می شود، محیط های اختصاصی می تواند جهت جدا كردن این ارگانیسم مورد استفاده قرار گیرد. در این گونه مواد پزشك باید آزمایشگاه را جهت كشت نمونه به منظور جداسازی لژیونلا آگاه سازد.
ب- مایع صفاقی (Peritoneal fluid)
فضای صفاقی شامل احشائی مانند كبد، پانكراس، معده، روده ها، مثانه، لوله های فالوپ طحال و تخمدانها می باشد. كلیه ها در وضعیت خلف صفاقی هستند. در یك فرد سالم فضای صفاقی حاوی مقدار كمی مایع بوده كه عمدتاً جهت مرطوب نمودن سطح صفاقی می باشد. مایع صفاقی طبیعی حاوی 300 گلبول سفید در هر میلی لیتر می باشد، اما مقدار پروتئین و وزن مخصوص آن پائین است.
عوامل عفونی از طریق سوراخ شدن روده، عفونت احشاء داخل شكم، از طریق جریان خون، یا بوسیلة تلقیح خارجی (مانند جراحی و تروما) به پریتون انتقال می یابند. در PID یا بیماری التهابی لگن، ارگانیسم ها از طریق كانالهای طبیعی لولة فالوپ به فضای صفاقی می رسند. در پریتونیت اولیه كانون عفونت مشهود نیست.
پریتونیت ثانویه به علت پارگی یك عضو احشائی یا سایر منابع شناخته شده عفونت ایجاد می شود. در طی یك عفونت یا پروسه التهابی، مایع افزایش یافته و در فضای صفاقی تجمع می یابد. این مایع معمولاً آسیت یا مایع آسیتی نامیده میشود كه معمولاً سلولهای التهابی آن افزایش یافته و مقدار پروتئین آن بالاست.
ارگانیسم هائی كه از نمونه یك بیمار مبتلا به پریتونیت اولیه جدا می شود با سن بیمار تغییر می كند شایعترین عامل اتیولوژیك در بچه ها استرپتوكوك پنومونیه و استرپتوكوك گروه A می باشد انتروباكتریاسه ها، سایر باسیل های گرم منفی و استافیلوكوك نیز ممكن است جدا شوند. در بالغین، اشریشیاكولی شایعترین، عامل بوده و متعاقب آن استرپتوكوك پنومونیه و استرپتوكوك گروه A قرار دارند. عفونت پلی میكروبی هنگامیكه فقط باكتریهای بیهوازی با بیماری مرتبط باشند شایع نیست. در میان زنان فعال از نظر جنسی، نایسریاگنوره و كلامیدیا تراكوماتیس عوامل شایع عفونت های تنفسی، اغلب در شكل پری هپاتیت (كه سندرم فیتز – هاگ – كورتیس نامیده می شود) هستند. عوامل قارچی ایجاد كننده پریتونیت شایع نیستند. اما گونه های كاندیدا را می توان از بیمارانی كه سیستم ایمنی آنها سركوب شده یا بمدت طولانی داروهای ضدمیكروبی مصرف نموده اند، جدا نمود. كوكسیدیوئیدس ایمیتیدس یك عامل غیرمعمول پریتونیت در مناطق آندمیك (مانند جنوب غربی ایالات متحده) است.
پریتونیت ثانویه در نتیجه سوراخ شدن یك عضو احشائی، جراحی، جراحات ناشی از صدمه، اتصال ضعیف دیوارة یك عضو احشائی ناشی از بیماری های تخریب كننده (كولیت اولسراتیو، كارسنوما) انسداد، یا یك عفونت قبلی (آبسه كبدی، سالپنژیت، سپتی سمی و غیره) ایجاد می شود.
طبیعت، جایگاه و اتیولوژی فرآیند زمینه ای تابع عواملی هستند كه از مایع پریتون جدا می گردد. با داشتن زمینه بیماری التهابی لگن (PID)، گنوكوك، بیهوازیها و كلامیدیا جدا خواهند شد. در پریتونیت یا آبسه های داخل شكمی عموماً بیهوازها را می توان به همراه انتروباكتریاسه ها، انتروكوك یا سایر استرپتوكوك ها جدا نمود. در بیمارانی كه فلور روده ای آنها بوسیلة درمان ضد میكروبی تغییر یافته است، باسیل های گرم – منفی مقاوم و استافیلوكوك اورئوس ممكن است دخیل باشند. از آنجائیكه در روده باكتریهای بیهوازی هزار برابر باكتریهای هوازی هستند، بنابراین جای تعجب نیست كه نقش باكتری های بیهوازی شاید با باكتریهای اختیاری عمل سینرژیسمی داشته باشند. ارگانیسم هائی كه احتمالاً جدا می شوند اشریشیا كولی، گروه باكتروئیدس فراجیلیس، انتروكوك و سایر استرپتوكوك ها، گونه های باكتروئیدس، سایر باسیلهای گرم – منفی هوازی، كوكسی های گرم – مثبت بیهوازی و كلوستریدیوم هستند.
نمونه یا بوسیلة آسپیراسیون از طریق پوست (پاراسنتز) و یا در هنگام عمل جراحی جمع آوری شده و جهت تهیه گسترش و كشت به آزمایشگاه فرستاده می شود. انتقال نمونه باید در ویال بیهوازی انجام شود. معمولاً 1 تا 5 میلی لیتر مایع جهت تشخیص عامل ایجاد كننده پریتونیت كفایت می كند، اما با مقادیر بیشتر نیز عملی است. به علت اینكه نمونه ممكن است حاوی باكتریهای بیهوازی نیز باشد بایستی هر چه سریعتر بر روی محیط های كشت تلقیح شوند. اگر تعداد زیادی از یك مادة شفاف سرمی خونی به آزمایشگاه برسد، باید بمدت 15 دقیقه در g×1500 سانتریفوژ شود. محیط های كشت باكتریولوژیك بایستی شامل آگار شكلاته و سایر محیط های لازم جهت رشد گنوكوك و گاهی گونه های هموفیلوس نیز باشند. روشهای مناسب جهت جداسازی قارچها، كلامیدیا و ویروسها در صورت درخواست باید به كار روند.
ج- مایع دیالیز صفاقی (Peritoneal dialysis fluid)
چند هزار بیمار مبتلا به بیماری كلیه مرحلة آخر با روش دیالیز صفاقی مزمن سیار (CAPD) به حیات خود ادامه می دهند. در این روش مایع به داخل حفرة شكمی تزریق شده مدت زمانی اجازه می دهند كه آب و املاح تعویض شوند و سپس مایع را خارج می سازند در این بیماران معدل پریتونیت دوبار در سال برای هر بیمار می باشد. پریتونیت از نظر بالینی بوسیلة وجود یك مایع دیالیز كد رابری با یا بدون درد شكمی، یا فقط درد شكمی تشخیص داده می شود. گر چه گلبولهای سفید معمولاً به تعداد زیادی وجود دارند (بیشتر از 100 لكوسیت در میلی لیتر نشانة عفونت است)، اما تعداد ارگانیسم ها جهت تشخیص آنها بر روی لام رنگ آمیزی شده از رسوب مایع پریتون بسیار كم است. قارچها ساده تر تشخیص داده می شوند. اغلب عفونتها از فلور طبیعی پوست خود بیماران نشأت می گیرد. استافیلوكوك اپیدرمیدیس و استافیلوكوك اورئوس از عوامل شایع هستند و پس از آنها استرپتوكوك ها، باسیل های گرم منفی هوازی یا اختیاری، گونه های كاندیدا، گونه های كورینه باكتریوم و سایر باكتریها می باشند. مقدار اكسیژن مایع دیالیز صفاقی بسیار بالا بوده و بنابراین اجازه گسترش به عفونتهای بیهوازی را می دهند. در میان باسیلهای گرم – منفی جدا شده، گونه های سودوموناس، اسینتوباكتر و انتروباكتریاسه ها شایع هستند. آلودگی وسائل دیالیز نیز ممكن است در ایجاد عفونت دیالیز صفاقی مشاركت نماید. مایع دیالیز صفاقی معمولاً در یك لولة استریل یا لیوان ادرار به آزمایشگاه می رسد. حجم قابل قبول جهت پذیرش نمونه حداقل 10 میلی لیتر می باشد. اغلب بیماران مبتلا به پریتونیت یك مایع صفاقی با ظاهر كدرابری دارند كه گلبولهای سفید آن بیشتر از 100 عدد در میلی لیتر متر مكعب می باشد. اگر كیسه دیالیز صفاقی به آزمایشگاه رسید، ابتدا آنرا با الكل 70% تمیز نموده و سپس با استفاده از یك سرنگ و سوزن مایع را جهت كشت آسپیره می نمائیم. مایع را می توان مستقیماً به محیط كشت خون تلقیح كرد. بدین منظور 10 میلی لیتر (و حداقل 2 میلی لیتر) مایع را به دو شیشه كشت خون تلقیح می نمائیم. جهت كشت با سایر روشها باید مایع را تغلیظ نمود. در صورتیكه مایع نیز شفاف باشد باید آنرا بوسیلة سانتریفوژ یا فیلتراسیون مانند سایر مایعات شفاف بدن تغلیظ نمود. مطالعات نشان داده كه لیز كردن لكوسیت ها قبل از سانتریفوژ كردن بازیافت عوامل موثر را تسریع می كند. فیلتراسیون، مایع از طریق یك غشاء با سوراخهای 45/0، میكرومتر باعث می گردد كه بتوان حجم بیشتری از مایع را مورد آزمایش قرار داد و نتایج بهتری نیز كسب كرد. از آنجائیكه ممكن است تعداد ارگانیسم عفونی در مایع بسیار پائین باشد (یك باكتری در هر 10 میلی لیتر مایع). مقدار زیادی از مایع باید مورد آزمایش قرار گیرد. آزمایش رسوب حداقل 50 میلی لیتر از مایع توصیه می گردد. رنگ آمیزی گرم و یا آكریدین – نارنجی (AO) باید انجام شود حتی اگر تعداد باكتریهای فراهم شده پائین باشد. اگر نمونه فیلتر شده باشد، فیلتر را باید به روش آسپتیك سه قطعه كرده، یكی را روی آگار شكلاته جهت انكوباسیون در مجاورت CO2 5%% یكی را روی آگار مك كانكی و دیگری را روی آگار خوندار جهت انكوباسیون بیهوازی قرار می دهیم. رسوب باید محیط های هوازی و تیوگلیكولات و آبگوشت های مشابه تلقیح شود، گر چه محیط های بیهوازی ضروری نیستند.
د- مایع پریكارد (Pericardial fluid)
قلب و عروق خونی بزرگ متصل به آن بوسیلة یك بافت محافظ بنام پریكارد پوشیده شده اند. فضای بین اپیكارد (غشاء احاطه كننده عضله قلب) و پریكارد، فضای پریكارد نامیده شده كه محتوی 15 تا 20 میلی لیتر مایع شفاف است. اگر یك عامل عفونی در مایع پریكارد وجود داشته باشد پریكارد سفت و متورم شده و ممكن است عمل قلب و جریان خون را مختل نماید. این حالت تامپوناد (tamponade) نامیده می شوند. عوامل پریكاردیت معمولا ویروسها بوده، همچنین ممكن است انگلها، باكتریها و برخی از قارچها با این بیماری همراه باشند.
التهاب خود عضلة قلب (میوكاردیت) ممكن است با پریكاردیت همراه باشد. آسیب زائی بیماری به دلیل پاسخهای التهابی میزبان با مشاركت افزایش ساخت مایع و سلول و تخریب بافتی است. عوامل بسیار شایع پریكاردیت و میوكاردیت انتروویروسها خصوصاً كوكساكی ویروسهای A و B، اكوویروسها نقش كمتری دارند. در میان عوامل غیرویروسی مایكوپلاسما پنومونیه، انتروباكتریاسه ها، سایر باسیلهای گرم – منفی، باكتریهای بیهوازی، مایكوباكتریوم توبركلوزیس، كلامیدیا، استافیلوكوك اورئوس و استرپتوكوك پنومونیه، كوكسیدیوئیدس ایمیتیس، آسپرژیلوس، گونه های كاندیدا، كریپتوكوكوس نئوفورمانس، هیستوپلاسما كپسولاتوم، آنتامباهیستولیتیكا و توكسوپلاسما گوندی را می توان نام برد. سایر باكتریها، قارچها و عوامل انگلی را نیز از افیوژن پریكارد جدا نموده اند. بدین دلیل همة عوامل را باید مدنظر قرار داد. بیمارانی كه مبتلا به پریكاردیت ناشی از عوامل غیر ویروسی بوده اند، اغلب به دلیلی ایمنی آنها سركوب شده است.
جمع آوری افیوژن پریكارد بوسیلة آسپیراسیون سوزنی و با كمك تصاویر الكتروكاردیوگرافی و توسط روشهای جراحی انجام می پذیرد. پرسنل آزمایشگاه باید در تهیه محیط های مناسب، محیط های كشت بافتی و روشهای رنگ آمیزی كار كشته و مجرب بوده و سریعاً آنها را در دسترس قرار دهند. مایع را باید طبق روشهای گفته شده مورد بررسی قرار داد.
هـ مایع مفصلی (Joint fluid)
آرتریت عفونی ممكن است در هر مفصل بدن ایجاد شود. این عفونت معمولاً ثانویه به گسترش خونی باكتریها و با شیوع كمتر قارچها بوده ممكن است به دلیل توسعه عفونت از استخوان به مفصل، متعاقب تزریق دارو (خصوصاً كورتیكواستروئیدها) به مفصل یا بعد از قرار دادن وسایل مصنوعی (مثلاً جایگزینی كامل استخوان مفصل ران) ایجاد شود. اگر چه آرتریت عفونی معمولاً فقط در یك جا ایجاد می شود (تك مفصلی) با گسترش خونی باكتریها یا قارچها ممكن است بیشتر از یك مفصل را درگیر نماید (چند مفصلی). زانو و مفصل ران شایعترین مفاصل مبتلا هستند. علاوه بر عفونت های همراه با میكروارگانیسم زنده در مفصل، آرتریت استریل خود محدود شونده به دلیل واكنش بین آنتی ژن – آنتی بادی پس از یك عفونت مانند مننژیت مننگوكوكسمی ممكن است ایجاد شود. وقتی نمی توان یك عامل اتیولوژیك را در نمونة مایع مفصلی جدا نمود، یا عامل زنده ای وجود ندارد و یا روشهای كشت و حمل و نقل كفایت لازمه را ندارند. مثلاً،حتی در بهترین شرایط، بورلیابورگدوفری از مایع مفصلی كمتر از 20% مبتلایان به بیماری لازم جدا شده است. نتایج آزمونهای غیراختصاصی مانند افزایش گلبولهای سفید، كاهش گلوكز یا افزایش پروتئین ممكن است بر یك عامل عفونی دلالت داشته باشند، اما قطعی نیستند. بعد از یك عفونت سیستمیك ممكن است باكتریهای ال فرم (L-form) در مایع مفصلی باقی بمانند اما چنین ارگانیسم هائی عموماً از مایع مفصلی ایزوله نمی شوند. استافیلوكوك اورئوس شایعترین عامل اتیولوژیك آرتریت عفونی است و تقریباً 70% چنین عفونتهائی را شامل می شود. اما، در بالغین با سن پائین تر از 30 سال، بیشتر نایسریاگنوره جدا می گردد. هموفیلوس آنفلوآنزا شایعترین عامل باكتریمی در بچه زیر 2 سال بوده و متعاقب آن شایعترین عامل آرتریت عفونی است، بعد از آن استافیلوكوك اورئوس قرار دارد. استرپتوكوكها مانند استرپتوكوكهای گروه A و B، پنوموكوك، استرپتوكوك ویریدانس در میان عوامل باكتریال مرتبط با آرتریت عفونی در تمام سنین غالب هستند. باكتروئیدسها شامل باكتروئیدس فراجیلیس نیز ممكن است جدا گردد. فوزوباكتریوم نكرفوزم كه عمدتاً بیش از یك مفصل را درگیر می كند نیز ممكن است از آرتریت عفونی جدا شود.
- در میان مردمی كه در مناطق مشخص آندمیك ایالات متحده و اروپا زندگی می كنند، آرتریت عفونی شكل بالینی غالب در بیماری لایم می باشد، برخی از عواملی كه عموماً بیشتر موجب آرتریت عفونی می گردند در لیست زیر آورده شده اند.
مهمترین عمل این ارگانیسم ها تحریك پاسخ التهابی میزبان است، كه معمولاً مسئول پاتولوژی عفونت است. آرتریت یكی از علائم مشخص بیماریهای عفونی ایجاد شده بوسیلة نایسریا یا گنوره و استرپتوباسیلوس مونیلیفرمیس (این عامل را نمی توان از مایع مفصلی جدا نمود) می باشد. احتمالاً در هنگام عفونت فعال كمپلكس آنتی ژن – آنتی بادی تشكیل شده و در مفصل تجمع می یابد. این كمپلكس ایجاد پاسخ های التهابی نموده كه نهایتاً منجر به تخریب مفصل می گردد. از عوامل غیرمعمول آرتریت عفونی می توان ویروسها، مخمرها و مایكوپلاسماها را نام برد. عفونت در مفاصل مصنوعی معمولا با عوامل اتیولوژیك متفاوت تری نسبت به مفصل سالم ایجاد می شود. بعد از قرار دادن یك پروتز، ارگانیسم هائی كه در هنگام عمل جراحی وارد مفصل شده اند به تدریج تكثیر یافته تا تعداد آنها به یك حد بحرانی برسد و سپس در میزبان ایجاد پاسخ التهابی می نمایند. این حالت ممكن است مدتها پس از جراحی اولیه اتفاق افتد (تقریباً نیمی از تمامی عفونت های پروتزهای مفصلی بیشتر از یك سال بعد از جراحی اولیه اتفاق می افتد). شایعترین عوامل اتیولوژیك در این حالت فلور طبیعی پوست هستند كه عبارتند از: استافیلوكوك اپیدرمیدیس، سایر استافیلوكوكهای كوآگولاز – منفی، گونه های كورینه باكتریوم و گونه های پروپیونی باكتریوم. به گونه دیگر، ارگانیسم ها ممكن است بواسطة گسترش خونی از كانونهای عفونی دورتر به مفصل برسند.
نمونه ها، مانند سایر مایعات استریل بدن بطریق آسپیراسیون با سرنگ و سوزن استریل گرفته می شود. نمونه باید به ویالهای مخصوصی كه جهت انتقال باكتریهای بیهوازی طراحی شده اند منتقل شده تا زنده ماندن باكتریهای بیهوازی را تضمین نماید زیرا كه احتمال وجود باكتریهای بیهوازی بیشتر است. همچنین اثبات شده است كه تلقیح مقداری از نمونه اولیه به محیط كشت خون می توان سودمند باشد (خصوصاً در زمانی كه نتوان نمونه را سریعاً به آزمایشگاه انتقال داد). این كشت باید مانند كشت خون بررسی شود. این كار مزیت دیگری كه دارد این است كه اولاً بازیافت تعداد كم ارگانیسم ها را افزایش داده، ثانیاً به دلیل رقیق شدن نمونه در محیط مایع كشت خون اثر آنتی بیوتیك ها را كاهش می دهد. از سیترات سدیم یا سدیم پلی آنتول سولفانات نیز می توان به عنوان ضد انعقاد استفاده نمود. اگر نمونه دارای لخته است باید آنرا هموژنیزه نمود زیرا میكروارگانیسم ها تمایل دارند كه در لخته تجمع نمایند. گنوكوك از محیط های هایپرتونیك مانند محیط های حاوی سوكروز بهتر جدا می گردد. نمونه های چركی را باید مستقیماً به چندین محیط حاوی آگار تلقیح نمود. آگار شكلاته و یك آبگوشت غنی كننده مانند تیوگلیكولات جهت تأمین رشد باكتریهای سخت رشد مناسب هستند. همچنین نمونه را باید به یك محیط بیهوازی تلقیح كرد. اگر قارچها و مایكوباكتریها مورد ظن هستند، نمونه را باید جهت شناسائی این عوامل به محیط های اختصاصی تلقیح نمود. رنگ آمیزی مستقیم گرم، KOH یا كالكوفلور سفید جهت قارچها و رنگ آمیزی اسید – فاست جهت مایكوباكتریوم ها را می توان انجام داد.